
——
技术资源

我们为您提供了关于实验原理、实验关键影响因素、实验技术和相关技巧、操作流程、疑难问题及解答的有用信息
蛋白电泳基础知识
蛋白质和多肽
生物体蛋白质和多肽通常是由20种L-氨基酸的α-氨基和α-羧基缩合而成的线性连接的生物大分子,是生命活动的主要承担者。通常少于40个氨基酸残基组成的被称为多肽。要发挥生物学功能,蛋白质需要正确折叠为一个特定构型,40-50个氨基酸残基通常是一个功能性结构域大小的下限。肽链依靠氨基酸间残基的氢键、疏水相互作用、范德华力、二硫键及部分金属键等进一步折叠形成高级结构。蛋白质结构分为四级,一级结构就是蛋白质多肽链上从N端到C端氨基酸残基的组成序列;二级结构是指蛋白质分子中某一段肽链的局部空间结构,包括α螺旋、β折叠、β转角、无规卷曲等;三级结构是指由序列上相隔较远的氨基酸残基侧链的相互作用,而具有范围广泛的卷曲与折叠;四级结构是指部分由两条或多条具有三级结构的多肽(蛋白亚基)组成的蛋白质,通过非共价键结合成一个功能蛋白质。
真核生物蛋白质生物合成后通常还会进一步进行修饰,修饰通常包括磷酸化,N,O糖基化等等,修饰作用对蛋白质的功能发挥具有重要作用。
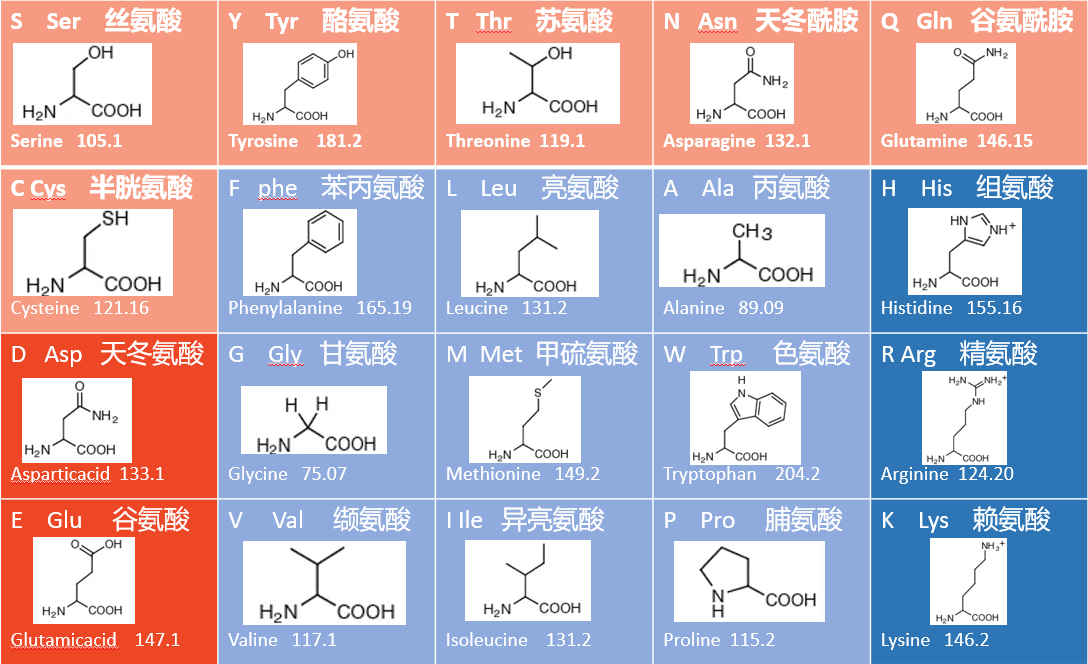
20种氨基酸图
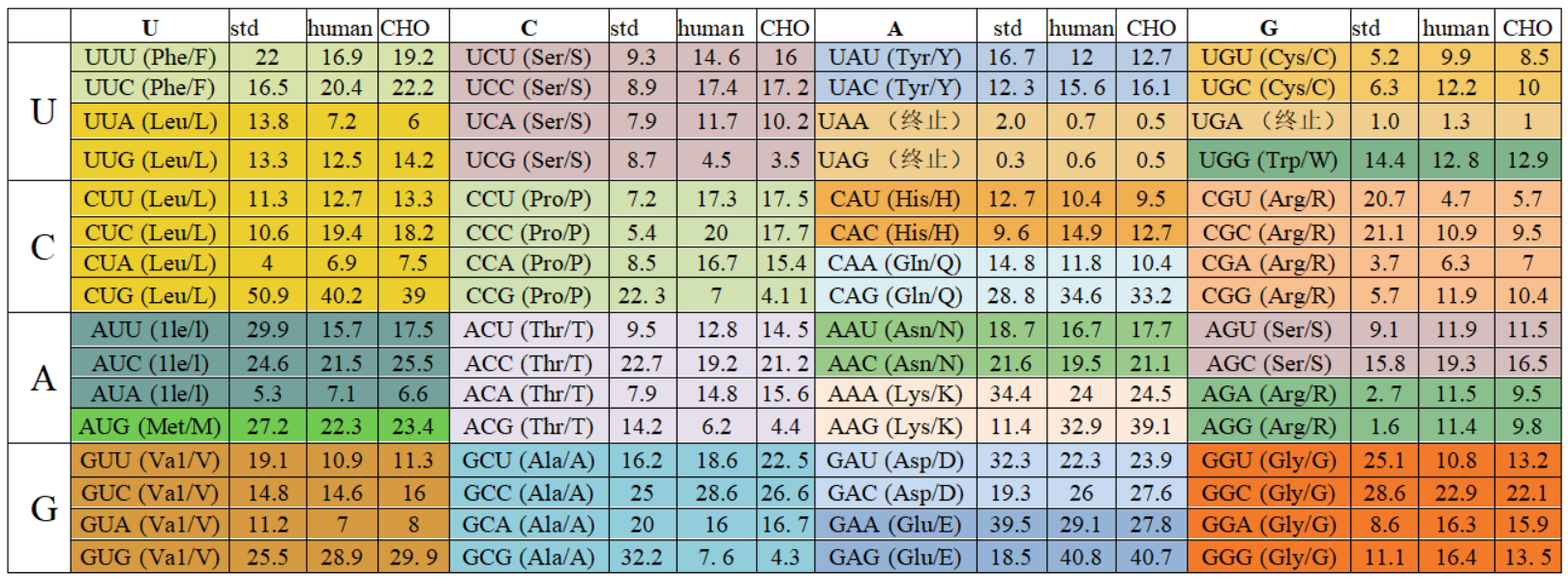
氨基酸密码子表及人和中国仓鼠卵细胞中氨基酸密码子使用频率
蛋白质分子量
蛋白质分子量是组成蛋白质分子的所有原子的原子量总和。蛋白质分子除组成肽链的氨基酸残基分子量外,还包括修饰物分子量。由于蛋白质修饰的存在,通常真核表达蛋白质是由不同修饰程度的蛋白质组成的混合物。通常天然蛋白质氨基酸残基的平均分子量大约在110左右,通过氨基酸残基数量可以大致估计未修饰蛋白质多肽的分子量。
蛋白质分子量实验测定
1.可通过质谱准确测定
2.通过SDS-PAGE测定蛋白质表观分子量
聚丙烯酰胺凝胶电泳(PAGE)根据蛋白质分子的电荷、形状和大小来分离的。蛋白质结合大量SDS后可以屏蔽蛋白质本身电荷的影响,形成棒状结构,SDS-PAGE迁移距离基本只与肽链长度相关,因此通过蛋白质分子量标准可以测定蛋白质的表观分子量。
在SDS-PAGE中蛋白质凝胶迁移距离与蛋白质分子量的对数(指数或幂)线性相关。由于氨基酸残基组成和序列不同,结合SDS的量有差异,因此具有同样计算分子量蛋白质,SDS-PAGE的表观分子量常常距理论值偏大或偏小,有时甚至很大。
SDS-PAGE电泳图谱表观分子量计算
确定测量基线,对不连续胶从分离胶界面开始,对梯度胶从加样孔底部开始
测量电泳条带的溶剂前沿相对于基线的距离
测量电泳条带的上沿相对于基线的距离,计算相对迁移率
以蛋白质分子量标准的分子量和迁移距离,或相对迁移率做回归曲线。线性拟合蛋白质分子量与迁移距离通常40kDa以上成幂曲线,20-100kDa成对数曲线,30kDa以下成指数曲线。
根据蛋白样品迁移距离,或相对迁移率,通过蛋白分子量标准和迁移距离的回归方程计算表观分子量。
蛋白质浓度测定
蛋白质浓度测定通常采用如下方法:
紫外(UV)吸收法:单一纯净蛋白质可以通过蛋白质的A280特征摩尔消光系数定量。
化学法:各种蛋白质的含氮量很接近,平均为16%,可以通过凯氏定氮法准确定量。
比色法:早期:双缩脲法,Folin-酚试剂法(Lowery法)。目前更多使用BCA法,考马斯亮蓝法(Bradford),更微量。
实验过程中,*常用的方法有BCA法、UV法以及SDS-PAGE半定量法。
BCA法:BCA方法是近年来广泛应用的蛋白质定量方法。其原理是,在碱性环境下蛋白质与二价铜离子络合并将二价铜离子还原为一价铜离子。BCA与一价铜离子结合形成稳定的蓝紫色复合物。该复合物在562 nm处有较高的吸光值,并与蛋白质浓度呈正比。
SDS-PAGE法:可以确定蛋白质纯度,根据蛋白质标准颜色深度可半定量
蛋白质电泳
聚丙烯酰胺凝胶电泳(PAGE)可根据蛋白质分子的电荷、形状和大小来分离蛋白。
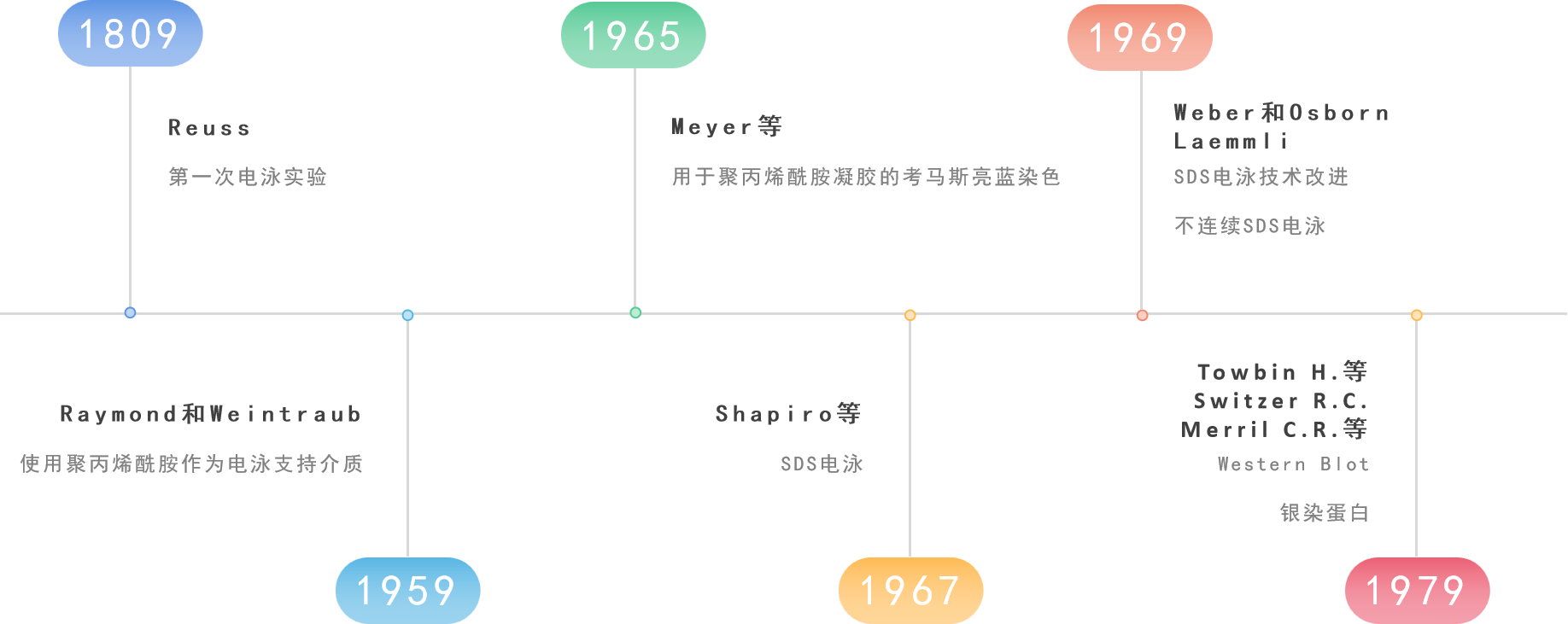
电泳技术发展史
蛋白质电泳历史可以追溯到1809年,详见下图:
SDS-PAGE:十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate -polyacrylamide gel electrophoresis)是测定蛋白质亚基分子量的*佳选择之一。
蛋白质结合大量SDS后可以屏蔽蛋白质本身电荷的影响,形成棒状结构排除形状的影响,迁移距离基本只与肽链长度相关,因此通过蛋白质分子量标准可以测定蛋白质的表观分子量。
在SDS-PAGE中蛋白质凝胶迁移距离与蛋白质分子量的对数(指数或幂)线性相关。由于蛋白质和多肽氨基酸残基组成不同,影响结合SDS的量,因此同样的计算分子量,其表观分子量常常距理论值偏大或偏小,有时甚至很大。
SDS-PAGE简单经济快速高效。15-100k可以有效分辨分子量差异10%的蛋白质(分辨率可以分辨大小差3%的多肽)。随着SDS-PAGE技术的发展,SDS-PAGE检测范围可达到2kD-500kD。
Copyright © 2017-2018 四川欣伯玉生物医药科技有限公司All rights reserved 版权所有
公司电话:18697676619
公司地址:四川省成都市双流区凤凰路269号11号楼

