
——
技术资源

我们为您提供了关于实验原理、实验关键影响因素、实验技术和相关技巧、操作流程、疑难问题及解答的有用信息
SDS-PAGE
SDS聚丙烯酰胺凝胶电泳
聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)是以聚丙烯酰胺凝胶作为支持介质的电泳技术。聚丙烯酰胺凝胶是一种网状结构,具有分子筛效应,可以根据蛋白质和核酸分子的电荷、形状和大小来分离。包括非变性聚丙烯酰氨凝胶电泳(native-PAGE)和变性聚丙烯酰氨凝胶电泳(蛋白质变性剂通常为SDS,核酸变性剂通常为尿素、甲酰胺等)。
SDS-PAGE,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate -polyacrylamide gel electrophoresis),是一种常用的根据蛋白质分子量大小分离样本中蛋白质和多肽的技术。
SDS-PAGE电泳的蛋白质迁移首先受SDS结合度的影响,其次还受缓冲体系,胶浓度,电压和电泳时间等影响。
Tris-Glycine体系:
经典Laemmli Tris-Glycine体系,特别是其不连续体系,成熟经典,条带锐利,成本低,而且非常适合手工灌胶。10-300kDa都能获得很好的分离效果。其缺点是碱性导致丙烯酰胺降解,保存期短。
商业预制Tris-Glycine胶为了延长保存期大多做了改良优化,导致性能较经典Laemmli Tris-Glycine体系降低。
Tris-Acetate体系:适应于大分子分离。通常250kDa以上建议使用Tris-Acetate体系。
Tricine体系:
为小分子多肽电泳分离发展的SDS-PAGE电泳体系,1-30kDa都能很好分离。通常15kDa以下建议使用Tricine体系。
Bis-Tris 体系
由于Tris-Glycine体系的保存效期短的缺陷,开发了Bis-Tris和Hepes-Tris体系。相比于传统Tris-Glycine体系胶,Bis-Tris凝胶中性略偏酸,有助于减少对蛋白质修饰的影响,并带来更清晰锐利的条带,不容易降解,在4-25℃的条件下能够长时间储存。因此商品化胶大多采用Bis-Tris 体系。
Bis-Tris 体系需要做大量优化工作,因此各家预制胶厂家提供的Bis-Tris胶表现差异较大。另外在Bis-Tris胶不同蛋白表观分子量变化比较大,成本也较高。
Bis-Tris Mops
Bis-Tris Mops分离的分子较大一些,可以分离15-250kDa的多肽分子。
Bis-Tris Mes
Bis-Tris Mes缓冲体系对较小分子效果较好,可以分离3.5-160kDa的多肽分子。
常用预制胶提供商(可咨询)
常用缓冲体系提供商(可咨询)
SDS-PAGE影响因素
丙烯酰胺和亚甲双丙烯酰胺
聚丙烯酰胺凝胶主要是由丙烯酰胺(Acrylamide,Acr)和N,N'-亚甲双丙烯酰胺(N,N'-Methylenebisacrylamide,Bis),在引发剂和增速剂存在时聚合成三维网状结构。
通常在配制的聚丙烯酰胺凝胶中添加0.1%的SDS,避免与蛋白结合的SDS脱落而达不到充分结合,影响电泳效果。也有部分预制胶为了扩展非变性聚丙烯酰氨凝胶电泳应用不添加SDS。
Acr/Bis的比例和凝胶浓度与平均孔径有关
当Bis的量占总凝胶浓度的5%时,平均孔径*小因此通常采用0.8/29.2和1/29的比例
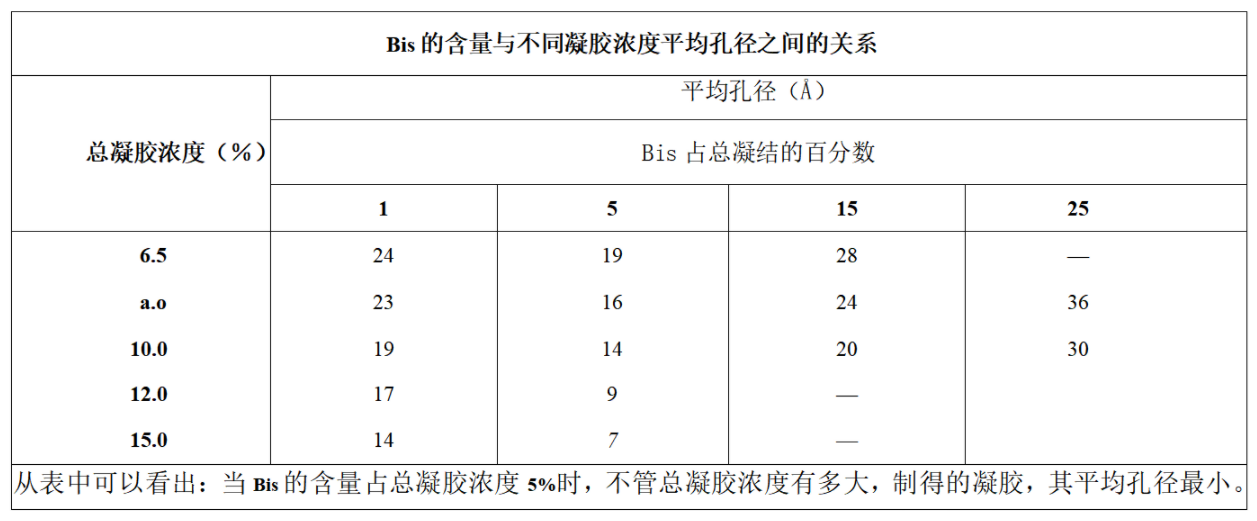
何忠效,张树政,电泳,科学出版社,1999,p15

许多厂商出售不含金属离子杂质的电泳级丙烯酰胺和N,N-亚甲双丙烯酰胺。含29%(m/V)丙烯酰胺和1%(m/V)N,N'-亚甲双丙烯酰胺的储液应以温热的去离子水(以促使双丙烯酰胺溶解)配制。丙烯酰胺和双丙烯酰胺在储存过程中会缓慢转化为丙烯酸和双丙烯酸,这种脱氨反应是由光和碱催化的,溶液pH值不超过7.0。该溶液应置暗色瓶中室温保存,每隔数月须重新配制。有些厂家会提供预混液。
N,N-亚甲双丙烯酰胺多次开瓶称取易失效,建议分装为小包装保存。
TEMED
TEMED是丙烯酰胺聚合形成的高分子,其作用是聚合反应是自由基聚合,需要有引发剂产生自由基将反应引发过硫酸铵就是引发剂,而TEMED可以催化过硫酸铵产生自由基,从而加速丙烯酰胺凝胶的聚合。TEMED具有浓烈的刺激性气味,使用时注意防护。
过硫酸铵APS
过硫酸铵在水溶液中能水解成硫酸氢铵和过氧化氢,为制备PAGE胶提供自由基。过硫酸铵易潮解失效,建议小瓶分装。过硫酸铵打开后建议一次性配成10%水溶液,分装冻于-20度。
缓冲体系
SDS-PAGE使用的*广泛的是TriGlycine体系,通常适用于10-300kDa的蛋白质分离,对于小分子的分离发展了Tricine体系,可以分离1-30kDa;对于大分子发展了用Tris-Acetate体系,可以分离大分子达到500kDa。但是由于TriGlycine体系保存期比较短,预制胶发展了Bis-Tris Mops体系和Bis-Tris Mes体系,以及Hepes-Tris体系。
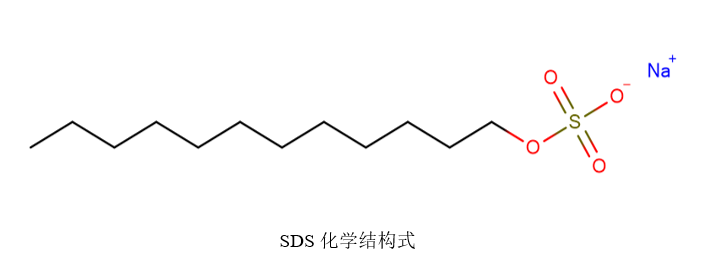
SDS
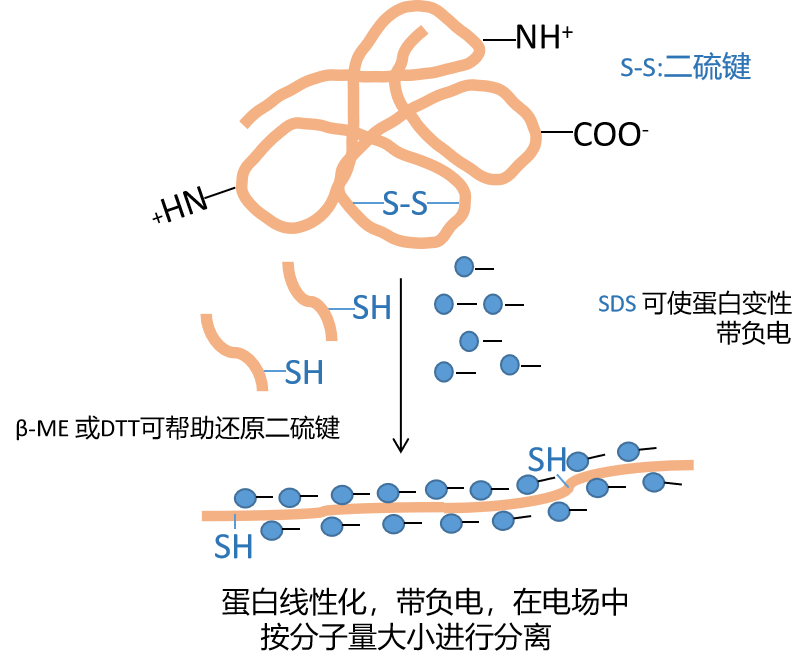
SDS是一种阴离子表面活性剂,可和蛋白质分子结合可形成密度相同的短棒状复合物,并且使蛋白质带上大量净负电荷,掩盖不同蛋白分子天然电荷差异(如图1.1)。蛋白样品与SDS充分结合后,可屏蔽蛋白结构和本身电荷的影响,基本只按照蛋白分子量大小分离。关于SDS的使用可以追溯到1964年,一名MIT的学生在分离大肠杆菌信封蛋白(envelope protein)时,发现SDS可使蛋白解聚并让蛋白在合适的缓冲体系里电泳,增强蛋白分离效果[1]。随着SDS-PAGE技术的发展,SDS-PAGE检测范围可达到2kDa-500kDa[2,3,4,5]。
SDS结合到蛋白质分子上的量受SDS单体浓度影响而不是总浓度:
1.当SDS单体浓度大于1mM时,大多数蛋白质与SDS达到充分结合,其结合重量比为1:1.4(此时平均约1.87个氨基酸残基结合一个SDS分子,不同氨基酸残基序列结合SDS的量有差异),如果降低到0.5mM,结合重量比只有1:0.4。为了保证充分结合,通常蛋白质与SDS的重量比应为1:3-4
2.保证多肽链二硫键充分还原达到充分结合(样品缓冲液beta巯基乙醇4-5%,DTT2-3%)。
3.只有在低离子强度的溶液中,SDS单体才具有较高的平衡浓度,因此样品缓冲液离子强度较低,一般为10-100mM。
4.SDS的产品质量:许多厂商售有特级SDS,其纯度足以满足电泳需要。理论上任何一种产品都能获得可重复的结果,但若用一个厂家的SDS代替另一种SDS,多肽迁移的谱图变化甚大,故建议专门使用同一个品牌的 SDS。若分离的蛋白质需要从胶上洗脱下来测序。应按Hunkapiller等(1983)提供的方法进一步纯化电泳级的SDS。
参考文献:
1、Pederson T. Turning a PAGE: the overnight sensation of SDS-polyacrylamide gel electrophoresis. FASEB J. 2008 Apr;22(4):949-53. doi: 10.1096/fj.08-0402ufm. Erratum in: FASEB J. 2019 May;33(5):6682. PMID: 18378803.
2、Matsumoto H, Haniu H, Komori N. Determination of Protein Molecular Weights on SDS-PAGE. Methods Mol Biol. 2019;1855:101-105. doi: 10.1007/978-1-4939-8793-1_10. PMID: 30426411.
3、Schägger H. Tricine-SDS-PAGE[J]. Nature Protocol, 2006, 1(1):16-22.
4、Monica CR, Fabiola AP, et al. Tris-Acetate Polyacrylamide Gradient Gels for the Simultaneous Electrophoretic Analysis of Proteins of Very High and Low Molecular Mass. Methods in molecular biology. 2019, 1855: 269-277.
5、Bolt MW, Mahoney PA. High-efficiency blotting of proteins of diverse sizes following sodium dodecyl sulfate-polyacrylamide gel electrophoresis. Anal Biochem. 1997 May 1;247(2):185-92. doi: 10.1006/abio.1997.2061. PMID: 9177676.
6、Omstein L.Arinals N.Acad.Sci,1964(121):321
7、M.R.格林,J.萨姆布鲁克. 分子克隆实验指南(第四版),第十九章,方案8 蛋白质的SDS-PAGE.
Copyright © 2017-2018 四川欣伯玉生物医药科技有限公司All rights reserved 版权所有
公司电话:18697676619
公司地址:四川省成都市双流区凤凰路269号11号楼

